طیف سنجی uv-vis چیست؟
اسپکتروفتومتر براساس جذب نور کار میکند. با استفاده از میزان نور جذب شده در طولموجهای خاص میتوان اطلاعات ارزشمندی از نمونه را به دست آورد. باید توجه کرد که میزان نور جذب شده به مقدار نمونه نیز بستگی دارد. توسط این طیف سنجی میتوان نمونه را از نظر کمی و کیفی تجزیه و تحلیل کرد.
اما قبل از این که به ادامه مطالب بپردازیم، قصد داریم تا بدانیم که این طیف سنجی uv-vis چیست؟
زمانی که نور به جسمی میتابد، با ماده وارد برهمکنش میشود. به طور مثال و برای درک بیشتر با توجه به شکل ۱، نور مرئی سفید رنگی به جسم تابیده میشود. همان طور که میدانید نور سفید ترکیبی از چندین طولموج (طول موج های رنگین کمان) است. زمانی که این نور به ماده میتابد، طولموجهای خاصی توسط جسم جذب میشود. رنگها یا همان طولموجهایی که توسط جسم جذب نمیشوند بازتاب میشوند. در شکل ۱ نور قرمز توسط پوست گوجه بازتاب میشود. ولی سایر رنگها جذب میشوند. همین پدیده باعث میشود تا ما گوجه را به رنگ قرمز ببینیم.

طیف جذبی یکی از ویژگیهایی است که در شیمی تحلیلی برای تعیین خصوصیات کمی مواد مورد استفاده قرار میگیرد. در طیف سنجی مرئی-فرابنفش قسمتی از نور جذب ماده شده و قسمتی از آن از ماده عبور میکند. نتیجه این طیف سنجی به صورت تابعی از طولموج در نمایشگر نشان داده میشود. از آن جایی که هر ماده جذب مخصوص به خود را دارد، یک رابطه منحصر به فردی بین ماده و طیف UV-VIS وجود دارد. بنابراین از این طیف میتوان اطلاعات کمی ماده را به دست آورد. در واقع میتوان با اندازهگیری میزان جذب در یک طول موج خاص، غلظت آنالیت را تعیین کرد.
اگر برای شما سوال پیش بیاید که اسپکتروفتومتر چیست؟ باید ذکر کنیم که این دستگاه میزان نور عبوری یا جذبی از یک ماده را اندازهگیری میکند. برای این کار ابتدا شدت نور جذبی (عبوری) ماده مرجع I۰ اندازهگیری میشود. سپس شدت نور جذبی (عبوری) از ماده مورد نظر به دست میآید. با مقایسه I و I۰ میتوان میزان جذب یا عبور نور را محاسبه کرد. (اگر با ماده مرجع آشنایی ندارید؛ تعریف مرجع را میتوانید در مقاله آنالیز کمی و کیفی با اسپکتروفتومتر مطالعه کنید.) در این روش طیف سنجی، نور با مولکولهای نمونه وارد برهمکنش میشود. در طی این فرآیند برخی از طول موجهای نور جذب ماده میشوند و برخی دیگر بدون تغییر از ماده عبور میکنند. اسپکتروفتومتر نتایج حاصل از این اندازهگیری را به صورت نمودار در صفحه نمایشگر نشان میدهد. در این نمودار محور عمودی جذب (عبور) و محور افقی طول موج را نشان میدهد. یک نمونه از این نمودارها که به آن طیف گفته میشود را میتوانید در شکل زیر مشاهده کنید.
از این طیف سنجی یووی ویز معمولا برای آنالیز مولکولهای آلی، یونهای معدنی و محلولها استفاده میشود. حتی از این روش میتوان مواد جامد مانند فیلمها یا شیشه را تجزیه و تحلیل کرد. این ویژگی بستگی به اسپکتروفتومتر مورد نظر شما دارد. اسپکتروفتومتر لِنا این ویژگی را در اختیار شما قرار میدهد.
در این دانشنامه ما قصد داریم طیف به دست آمده از اسپکتروفتومتر UV-VIS را مورد مطالعه قرار دهیم. اما قبل از پرداخت به این مورد ابتدا نحوه محاسبه میزان انتقال و جذب را شرح خواهیم داد. میزان انتقال و عبور در مقاله بیرلامبرت به صورت کاملتر بررسی شده است.
میزان انتقال و عبور نور
میزان انتقال یا عبور، درصد نوری است که از داخل ماده عبور میکند. میزان عبور نور از یک ماده به وسیله رابطه زیر به دست میآید.
T = I / I۰
معمولا این میزان انتقال بر حسب درصد بیان میشود:
T (%) = I/I۰ x100
از آن جایی که جذب و عبور نیز با یکدیگر رابطه دارند، میزان جذب نور نیز طبق رابطه زیر تعریف میشود:
A = – log T
همان طور که نشان دادیم میزان جذب (عبور) از نسبت شدتها به دست میآید. بنابراین واحدهای فیزیکی از صورت و مخرج کسر حذف میگردند. در نتیجه میزان جذب و انتقال بدون واحد فیزیکی هستند.
نتیجه حاصل از اندازهگیریهای اسپکتروفتومتر در نمودار ۱ نشان داده شده است. در این مثال محلول هلیوم تقریبا چهار طول موج نور را جذب میکند. این طولموج ها عبارتند از: ۳۷۰، ۴۵۰، ۴۸۰ و ۵۴۰ نانومتر. جذب نور به معنی کاهش شدید در طیف عبوری است.
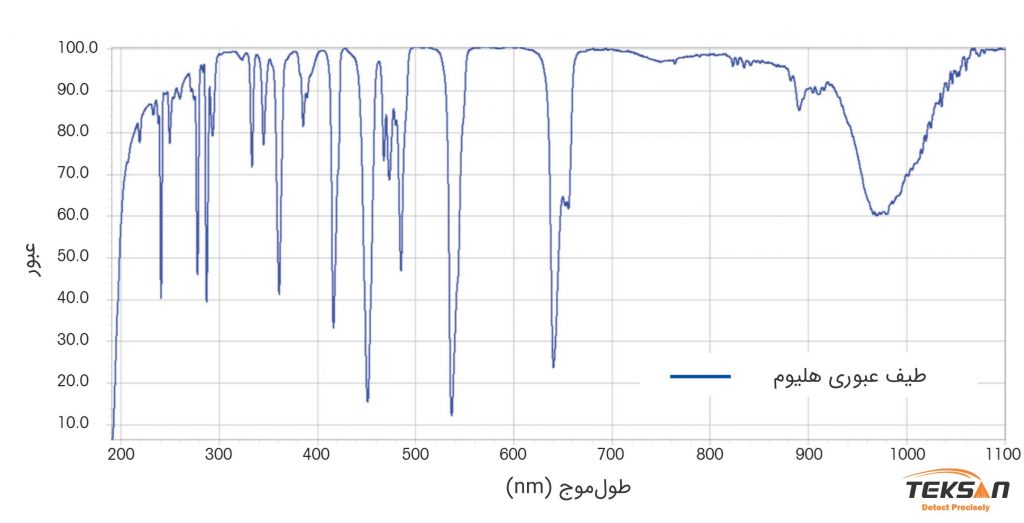
طیف جذب محلول هلیوم نیز به عنوان تابعی از طولموج در نمودار ۲ نشان داده شده است. در طولموجهایی که در بالا ذکر شده، جذب در بالاترین میزان خود قرار دارد. ارتفاع قلههای جذب مستقیما با غلظت گونهها متناسب است.
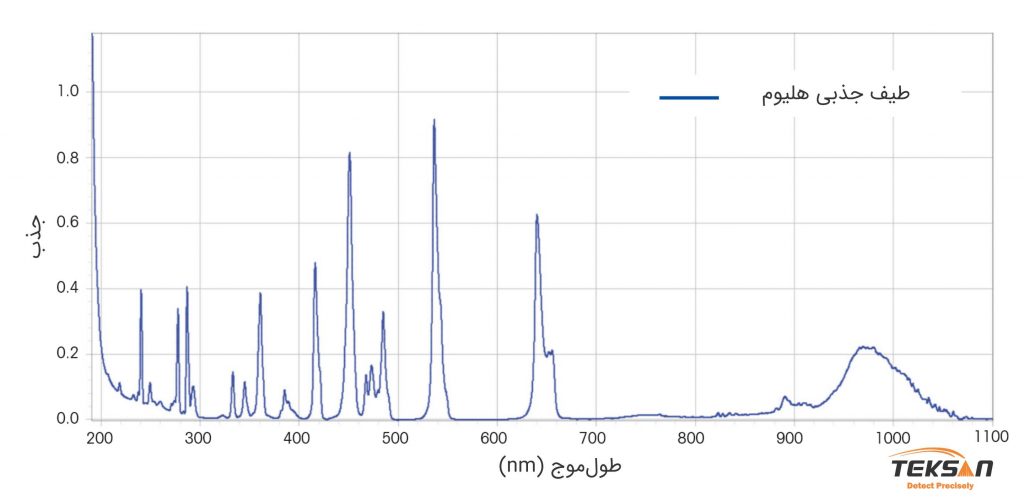
همان طور که گفته شد با استفاده از میزان جذب نور، غلظت آنالیت را میتوان محاسبه کرد. غلظت را میتوان با استفاده از قانون بیر لامبرت به دست آورد. به همین منظور در بخش بعدی به معرفی قانون بیر-لامبرت میپردازیم.
قانون بیرلامبرت
معادله بیر-لامبرت یک رابطه خطی است که به شکل زیر بیان میشود:
A = ɛlc
در معادله بالا ε ضریب جذب مولی، c غلظت و l طول مسیر نوری است.
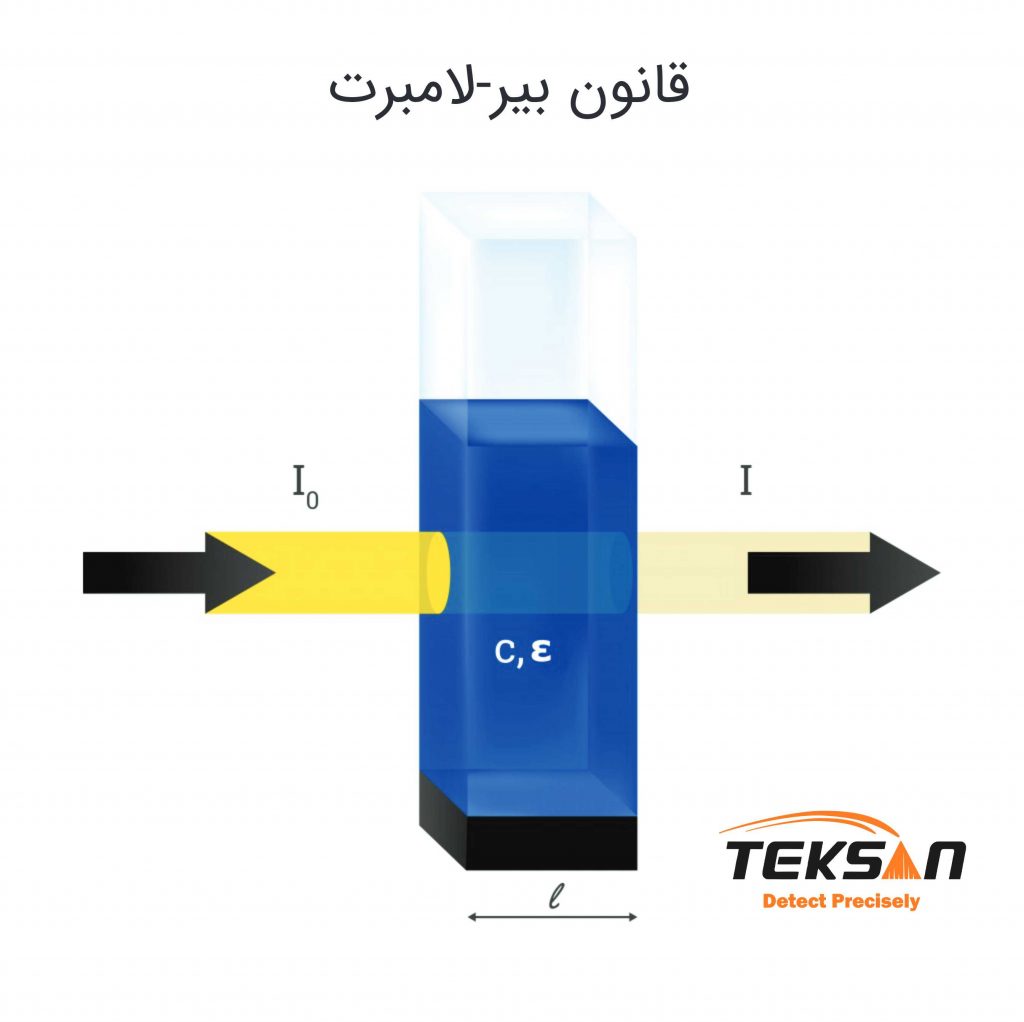
ε (ضریب جذب مولی): ضریب جذب یک خاصیت وابسته به نمونه است که از اندازهگیری میزان قدرت جذب یک نمونه در یک طولموج خاص به دست میآید.
l (طول مسیر نوری): در واقع l طول مسیری است که نور طی میکند. معمولا برای اندازهگیریها در اسپکتروفتومتر از کووت استفاده میشود. طول یک کووت استاندارد ۱ سانتیمتر است. به همین دلیل معمولا برای l عدد یک در نظر گرفته میشود.
A (میزان جذب): با یک اسپکتروفتومتر به راحتی میتوانید میزان جذب را از اندازهگیریها به دست آورید.
طبق قانون بیر-لامبرت در شرایط ایدهآل، غلظت ماده و میزان جذب آن به صورت خطی با هم متناسب هستند. به عبارتی هرچه غلظت یک محلول بیشتر باشد، نور بیشتری جذب میشود. با استفاده از اسپکتروفتومتر علاوه بر میزان جذب (عبور) نور، میتوان غلظت یک محلول را نیز اندازهگیری کرد. برای این منظور از منحنی استاندارد استفاده میشود. بسیاری از منحنیهای استاندارد خطی هستند و با استفاده از معادله y=mx+b ، میتوان غلظت محلول را به دست آورد. در این معادله m شیب و b عرض از مبدا است. در بعضی موارد بنا به دلایلی نمودار کالیبراسون از خط صاف خارج میشود که علتهای آن را میتوان در انحرافات قانون بیر لامبرت متوجه شد.
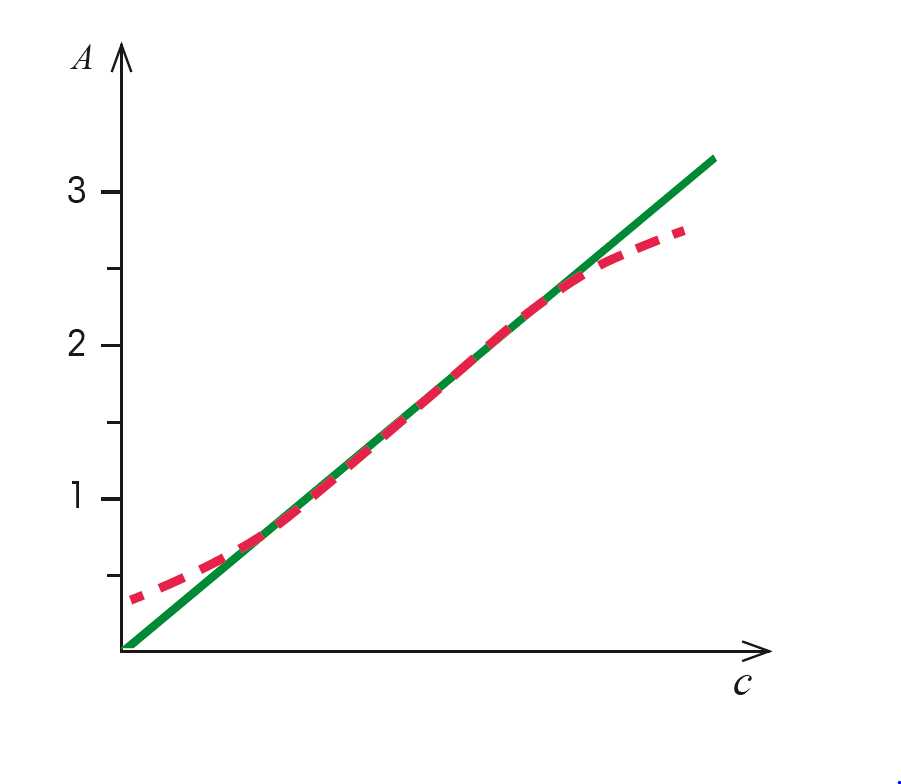
برای اندازهگیریهای بهینه، میزان جذب باید در محدوده خطی دستگاه باشد. همان طور که اشاره شد میزان جذب و غلظت متناسب است. بنابراین محدوده اندازهگیری جذب برای حفظ خطی بودن دستگاه باید بین ۰.۳ تا ۲.۵ باشد. به ازای جذبهای کمتر از ۰.۳ و بیشتر از ۲.۵ منحنی کالیبراسیون یک رفتار غیر خطی نشان میدهد. در نمودار ۳ رنگ سبز نشان دهنده خط کالیبراسیون است. منحنی قرمز نیز برای زمانی که خط کالیبراسیون به ازای A=2.5 و A=0.3 دچار انحراف میشود.
واکنشهای شیمیایی، نورهای سرگردان، انتخاب نادرست طولموج نیز از عواملی هستند که منحنی کالیبراسون را تحت تاثیر قرار میدهند. علاوه بر این محلولهای بسیار رقیق یا بسیار غلیظ، از عوامل محدود کننده قانون بیر-لامبرت هستند. این عوامل و انحرافات را به طور مفصل در مطلب قانون بیرلامبرت به زبان ساده شرح دادهایم.
آنالیز طیف uv/vis
با استفاده از اسپکتروفتومتر میتوان نمونهها را از لحاظ کمی و کیفی مورد تجزیه و تحلیل قرار داد. به همین منظور بخش بعدی را به آنالیزهای کمی وکیفی اختصاص میدهیم.
طیف سنجی UV-VIS در شیمی تحلیلی
قبل از این که به تجزیه و تحلیل کمی و کیفی طیف مرئی-فرابنفش بپردازیم، باید بدانیم که دلیل استفاده از این دستگاه چیست. بنابراین ابتدا دلایل استفاده از طیف UV-VIS را مطالعه میکنیم. سپس به سراغ تحلیلهای کمی و کیفی میرویم. دلایل اصلی اندازهگیری طیف Uv-Vis به صورت زیر است.
- با استفاده از طیف Uv-Vis میتوان اجزای ترکیبات را شناسایی کرد. به عبارتی موقعیت و مشخصات قلهها در طیف جذبی مشخصه ترکیبات خاص است. به عنوان مثال، ترکیبات آلی را میتوان با استفاده از طیف آنها شناسایی کرد.
- از قلههای طیف جذبی برای تعیین کمیت نمونهها استفاده میشود. به عنوان مثال غلظت نمونه را میتوان از ارتفاع قله محاسبه کرد (نمودار ۴).
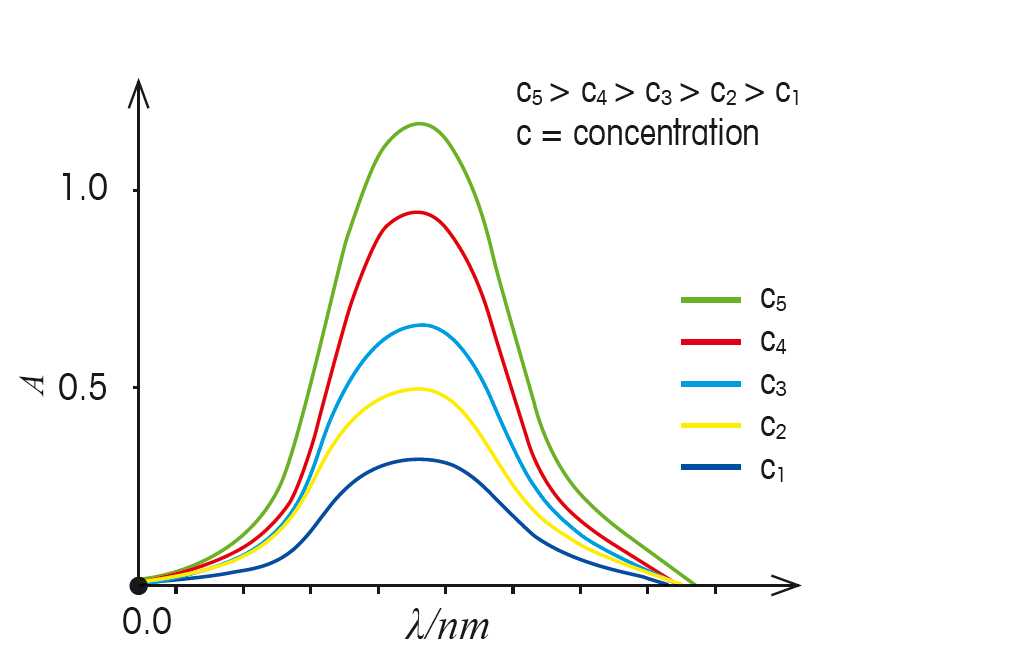
- از موقعیت قلهها در طیف جذبی، میتوان اطلاعات مربوط به ساختار مولکولی نمونه را به دست آورد. مثلا گروههای فانکشنال خاصی از یک ساختار مولکولی، مانند اکسیژن یا پیوند دوگانه کربن-کربن، طولموجهای مشخصی از نور را جذب میکنند.
- طیف UV-VIS خصوصیات فیزیکی مولکولها را نشان میدهد. به عنوان مثال:
-محاسبه ضریب خاموشی (extinction coefficient) نمونه
-محاسبه نقطه ذوب پروتئینها و اسیدهای نوکلئیک در دماهای مختلف
-تعیین نرخ واکنش با نظارت بر طیف جذبی به عنوان تابعی از زمان
-تعیین گاف باندی
- از موقعیت و مشخصات پیکهای طیف، میتوان اطلاعاتی در رابطه با محیط میکروسکوپی مولکولهای نمونه به دست آورد. به طور مثال وجود ناخالصیها یا سایر حلالها در محلول نمونه بر موقعیت و مشخصات قلهها اثر میگذارد. به عبارتی دیگر ممکن است که قلهها در اثر وجود ناخالصی پهنتر شوند و یا موقعیت آنها تغییر کند.
تجزیه و تحلیل کیفی اسپکتروفتومتر در شناسایی نمونهها
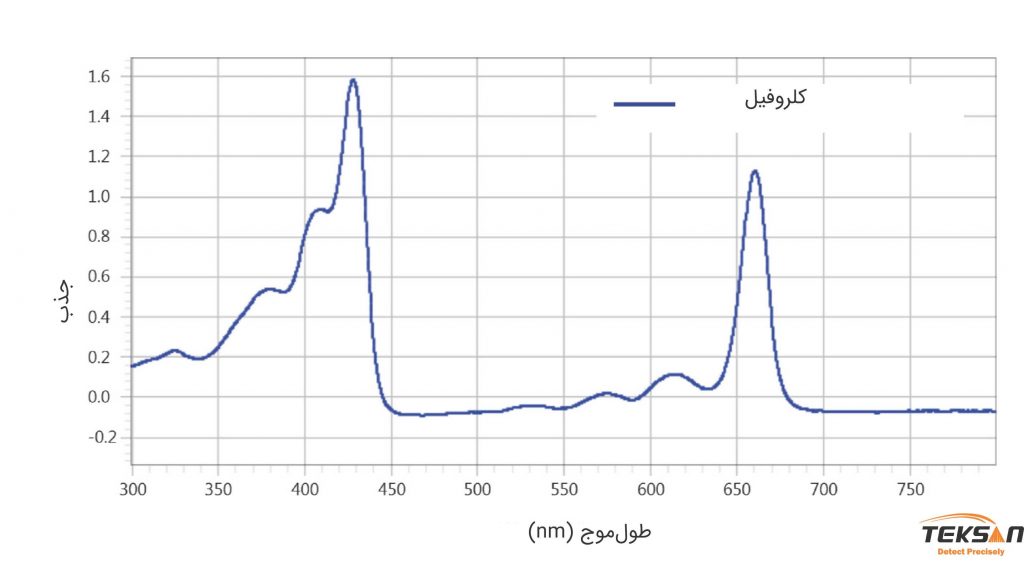
از اسپکتروفتومتر برای تجزیه و تحلیل کیفی نمونهها استفاده میشود. به این صورت که با کمک این دستگاه میتوان خالص بودن (یا وجود ناخالصی) نمونه را تشخیص داد. در حقیقت نمونه یک یا چند طولموج مشخص را جذب میکند. به همین دلیل هر نمونه یک طیف مشخص و منحصر به فرد دارد که میتوان از آن برای شناسایی مواد استفاده کرد. به عنوان مثال نمودار ۵ طیف کلروفیل را نشان میدهد. این مولکول مسئول رنگ سبز گیاهان است و یک باند جذبی قوی در نواحی بنفش،آبی و قرمز دارد.
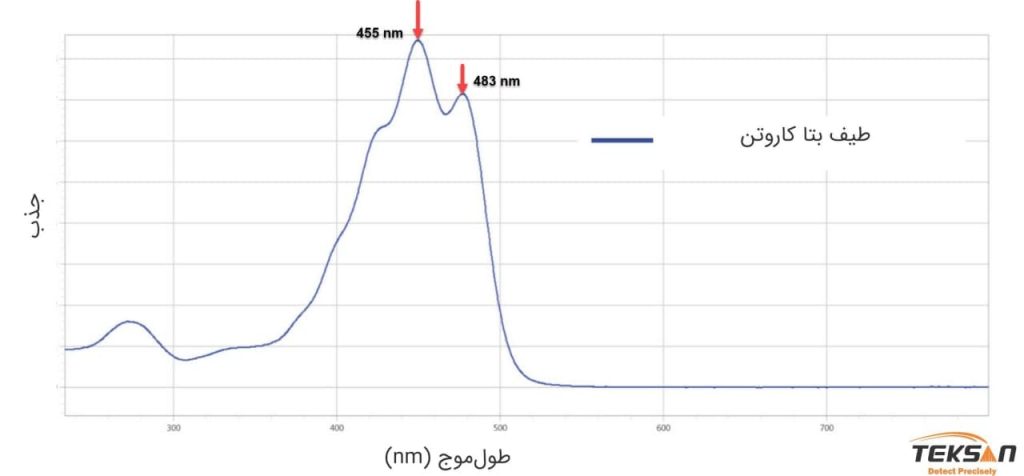
به عنوان یک مثال دیگر طیف جذبی بتا کاروتن در نمودار ۶ نشان داده شده است. بتا کاروتن، یک رنگدانه طبیعی نارنجی رنگ است که در گیاهان و میوهها به وفور یافت میشود. این مولکول دارای یک باند جذبی پهن در ناحیه آبی-بنفش است. در واقع این قله مشخصه این مولکول است. بتا کاروتن دارای یک شانه در طولموج ۴۲۷ نانومتر، یک قله در ۴۵۵ نانومتر و یک قله دیگر در ۴۸۳ نانومتر است. نسبت دو قله ۴۵۵ و ۴۸۳ نانومتر (A(455)/A(483)) عددی بین ۱.۱۴ و ۱.۱۸ است. این سه باند جذبی و نسبت A(455)/A(483) مولفههای شناسایی بتا کاروتن هستند.
تجزیه و تحلیل کمی اسپکتروفتومتر در تعیین غلظت
غلظت یک ترکیب در محلول را میتوان بر اساس قانون بیر-لامبرت، با استفاده از اسپکتروفتومتر از نظر کمی تعیین کرد. برای این کار ابتدا باید یک منحنی کالیبراسیون رسم شود. این منحنی با اندازهگیری میزان جذب چندین محلول استاندارد با غلظت شناخته شده به دست میآید. به این ترتیب میتوان غلظت نمونههایی مانند DNA، RNA، پروتئینها، کربوهیدراتها و یا ترکیبات آلی را تعیین کرد. نحوه رسم نمودار اسپکتروفتومتری را میتوانید از این مقاله بخوانید. ویدئو این مطلب نیز تهیه شده است.
نحوه تعیین غلظت در اسپکتروفتومتری
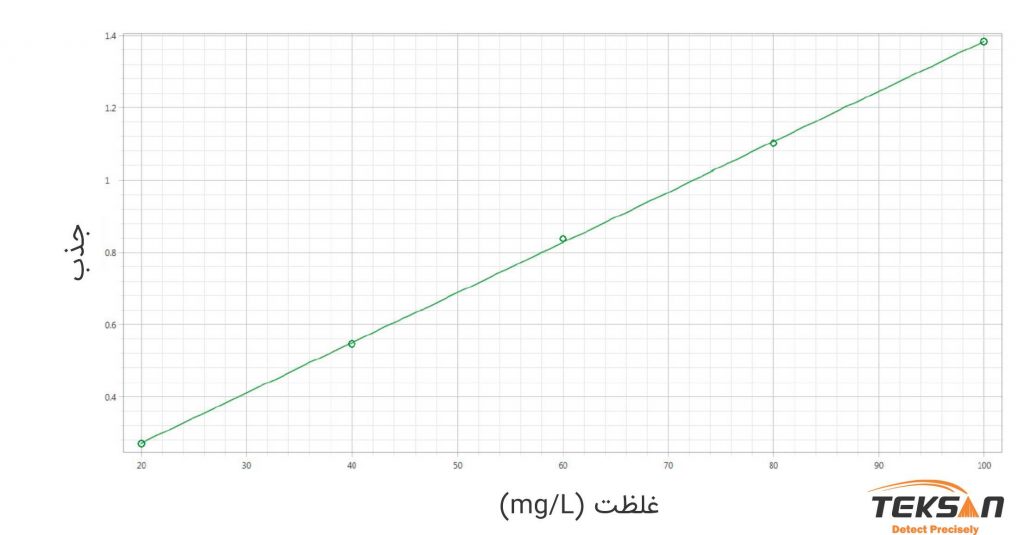
برای رسم منحنی کالیبراسیون به حداقل ۵ نمونه نیاز داریم. غلظت این نمونهها مشخص است و به کمک اسپکتروفتومتر میزان جذب این نمونهها را اندازهگیری میکنیم.
| نمونه | غلظت (mg/L) |
| نمونه ۱ | ۲۰ |
| نمونه ۲ | ۴۰ |
| نمونه ۳ | ۶۰ |
| نمونه ۴ | ۸۰ |
| نمونه ۵ | ۱۰۰ |
سپس نموداری مانند نمودار ۷ برای نمونهها رسم میکنیم. که در این نمودار محور افقی نشان دهنده غلظت و محور عمودی نشان دهنده میزان جذب نور است.
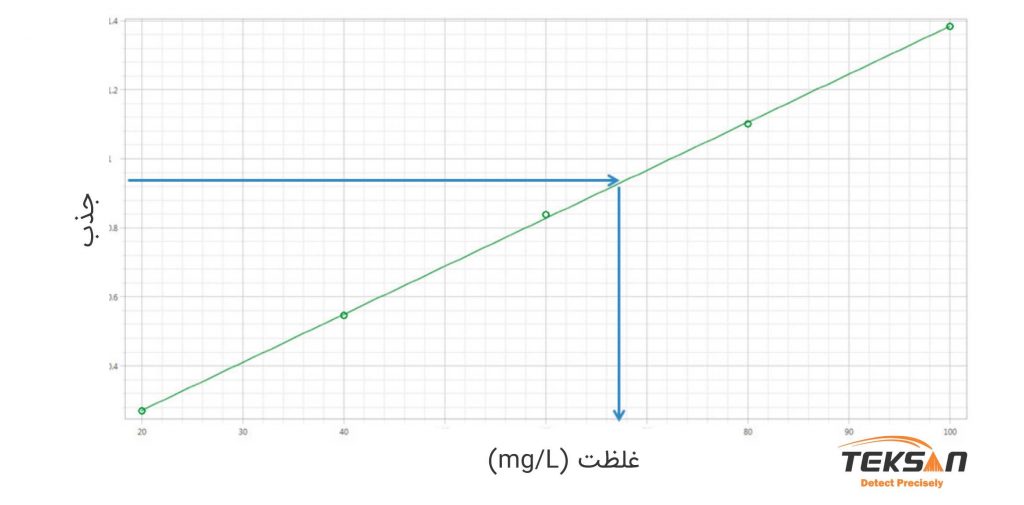
اکنون با استفاده از خط کالیبراسیون میتوان غلظت یک نمونه ناشناخته را از میزان جذب آن تعیین کرد. نمودار زیر این مطلب را بهتر به شما نشان میدهد.
تا این بخش از دانشنامه طیف UV-VIS را بررسی کردیم. اما باید بدانید که عوامل گوناگونی این طیف را تحت تاثیر قرار میدهند. در ادامه این عوامل را بررسی میکنیم.
عوامل تاثیرگذار بر طیف UV-VIS
عوامل گوناگونی بر طیف جذبی عبوری اثر میگذارند که ما این عوامل را به شکل زیر دستهبندی کردهایم:
- تاثیر انتقالات الکترونی بر طیف جذبی
- تاثیر گروههای کروموفور بر طیف جذبی
- تاثیر حلال بر طیف جذبی
- تاثیر فاز نمونه بر طیف جذبی
میزان نور جذب شده، مستقیما با مقدار آنالیت موجود در محلول متناسب است. با افزایش غلظت آنالیت، جذب نور نیز به صورت خطی افزایش مییابد. ولی انتقال نور از داخل نمونه به صورت تصاعدی کاهش مییابد و خطی نیست. در ناحیه مرئی-فرابنفش، جذب به ساختار الکترونی گونههای جذب کنننده نور مانند اتمها، مولکولها و یونها بستگی دارد. بنابراین در ادامه تاثیر انتقالات الکترونی بر طیف جذبی را بیان میکنیم.
تاثیر انتقالات الکترونی بر طیف جذبی
همان طور که در شکل ۳ نشان داده شده است، یک تراز انرژی الکترونی از سطوح انرژی ارتعاشی و یک تراز انرژی ارتعاشی از چندین سطوح انرژی چرخشی تشکیل شده است. هنگام برهمکنش یک فوتون با مولکول، در صورتی که انرژی فوتون اندازه اختلاف انرژی ترازهای الکترونی مولکول باشد؛ الکترون تحریک شده و از تراز پایه به یک تراز برانگیخته الکترونی گذار میکند. در حقیقت نور توسط مولکول جذب میشود. مقدار تابش جذب شده توسط آنالیت، به منظور به دست آوردن طیف، به عنوان تابعی از طول موج اندازهگیری میشود. بنابراین، طیف UV-VIS، یک نموداری از طول موج در برابر شدت است.
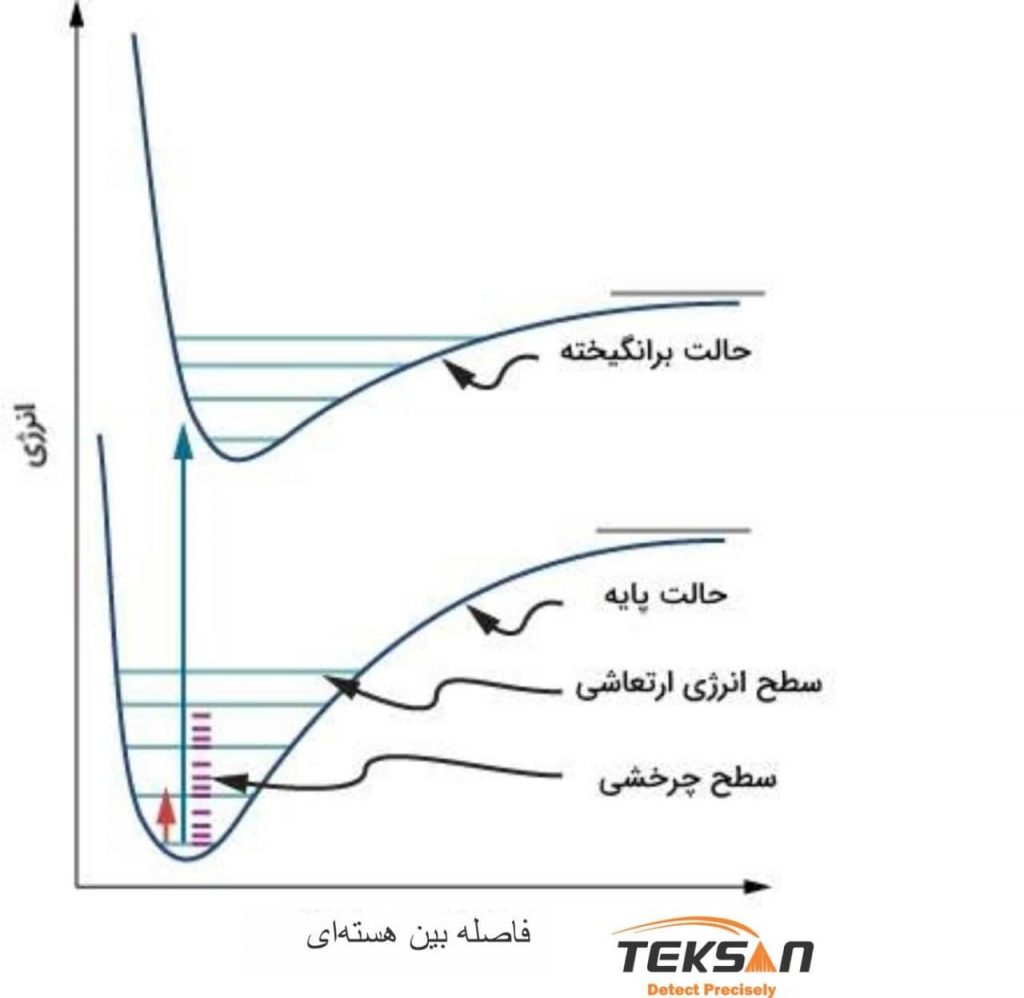
همان طور که گفته شد، جذب نور در مولکولها توسط الکترونها صورت میگیرد. الکترونها، فوتونهای نور را جذب کرده و به سطح انرژی بالاتری گذار میکنند. الکترونهای موجود در مولکولها را میتوان به سه دسته تقسیم کرد:
الکترونهای نوع σ
این الکترونها در ساخت پیوند یگانه کووالانسی نقش دارند و برای تحریک آنها انرژی زیادی مورد نیاز است.
الکترونهای نوع π
الکترونهای نوع π در ایجاد پیوند دوگانه یا سه گانه نقش دارند و برای تحریک آنها انرژی نسبتا کمی لازم است.
الکترونهای نوع n
این نوع الکترونها در ایجاد پیوند کووالانسی شرکت نداشته و به صورت آزاد در اطراف اتم قرار میگیرند. این الکترونها به الکترونهای غیر پیوندی نیز شهرت دارند و در مقایسه با الکترونهای نوع π و σ به انرژی تحریک کمتری نیاز دارند.
اکنون که با انواع الکترونها در پیوندها آشنا شدید به سراغ انواع انتقالات الکترونی میرویم.
انتقال الکترونی *σ→σ
این نوع انتقال به انرژی زیادی نیاز دارد. به همین دلیل انتقال الکترونی *σ→σ زمانی رخ میدهد که تحت تابش نور Uv دور قرار گیرد. به همین دلیل است که هیدروکربنهای اشباع شده در نور فرابنفش نزدیک شفاف به نظر میرسند.
آب در ناحیه فرابنفش نزدیک به عنوان حلال مورد استفاده قرار میگیرد. در این ناحیه میزان جذب نور آب (برای مسیر نوری ۱cm و λ=۱۹۰nm) برابر با ۰.۰۱ است. زیرا انتقالات الکترونی آب از نوع *σ→σ و *n→σ است.
انتقال الکترونی *n→σ
برای گذار الکترون نوع n از اتمهایی مانند O، N، S و Cl به یک اوربیتال مولکولی *σ، به انرژی نسبتا زیادی نیاز است.
انتقال الکترونی *n→π
این نوع انتقال الکترونی به انرژی کمی برای گذار نیاز دارد. انتقال *n→π بیشتر در مولکولهایی مشاهده میشود که شامل یک اتم هترو حاوی جفت الکترونهای منفرد است.
انتقال الکترونی *π→π
انرژی مورد نیاز برای انتقال الکترونی *π→π نسبتا کم است. ترکیباتی که دارای یک پیوند دوگانه اتیلنی هستند یک باند جذب قوی در حدود ۱۷۰ نانومتر را نشان میدهند.
شکل ۴ انواع انتقالات الکترونی و انرژی مورد نیاز برای این انتقالها را نشان میدهد. با توجه به این شکل میتوان نتیجه گرفت که میان چهار نوع انتقال الکترونی (*π→π*، n→σ*، n→π و *σ→σ)، انتقالهای الکترونی *n→π و *π→π بر طیف جذب آنالیت تأثیر میگذارند.
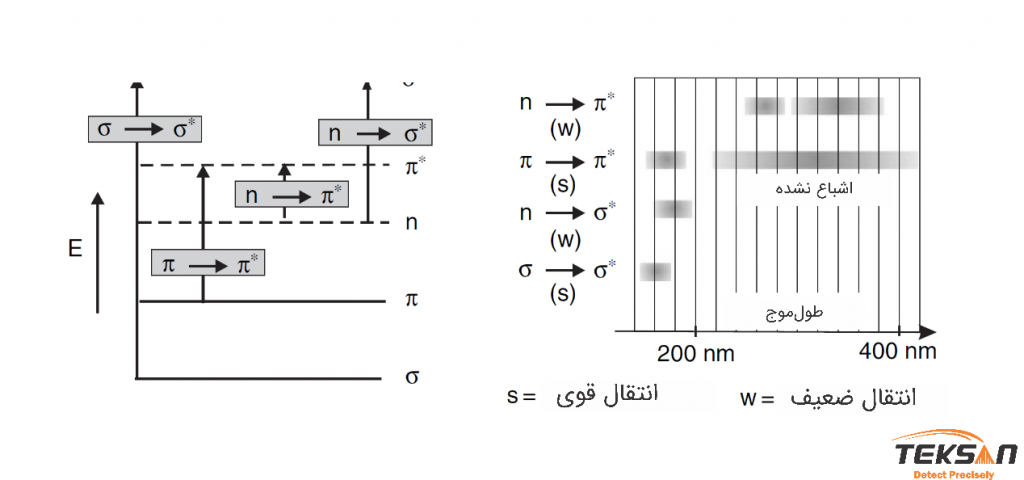
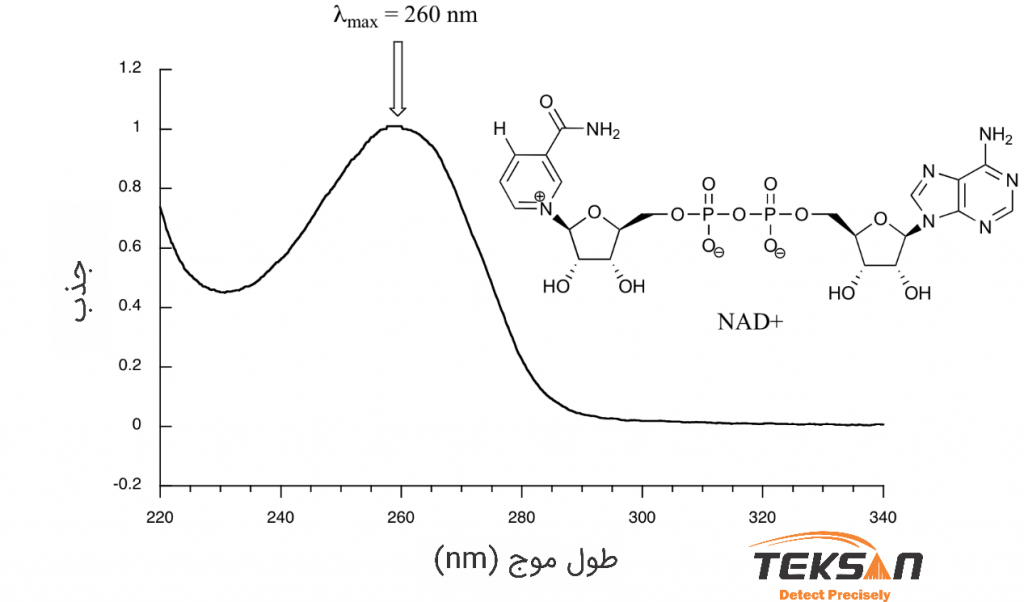
مولکولی مانند نیکوتینآمید آدنین دی نوکلئوتید (Nicotinamide adenine dinucleotide (NAD+)) را در نظر بگیرید. این مولکول نور UV را جذب میکند. زیرا دارای پیوندهای پای است. نمودار ۹ طیف جذبی این مولکول را نشان میدهد. مولکول +NAD در طول موج ۲۶۰ نانومتر دارای بیشترین جذب است. به بیانی دیگر اگر نور با این طول موج بر مولکول بتابد، مولکول تقریبا همه نور را جذب خواهد کرد. اکثر مواد در یک یا چند طول موج دارای بیشترین جذب است. با توجه بالا، در این طول موج انتقالات الکترونی از نوع *π→π هستند.
تاثیر گروههای کروموفور بر طیف جذبی
گروههای فانکشنال ترکیبات آلی (مانند کتونها، آمینها، مشتقات نیتروژن و غیره) در مولکولها نور UV-VIS را جذب میکنند. به این بخش از مولکول که مسئول جذب نور UV-VIS است کروموفور (Chromophore) گفته میشود. برای بعضی از مولکولهای دارای کروموفور یکسان، موقعیت و شدت باندهای جذب ثابت میماند. البته این در صورتی صادق است که کروموفورها با هم برهمکنشی نداشته باشند.
هنگامی که کروموفورها با یکدیگر برهمکنش دارند، طیف جذب به سمت طول موجهای بالاتر (اثر باتوکرومیک) با افزایش در شدت جذب (اثر هایپروکرومیک) جابجا میشود.
تاثیر حلال بر طیف جذبی
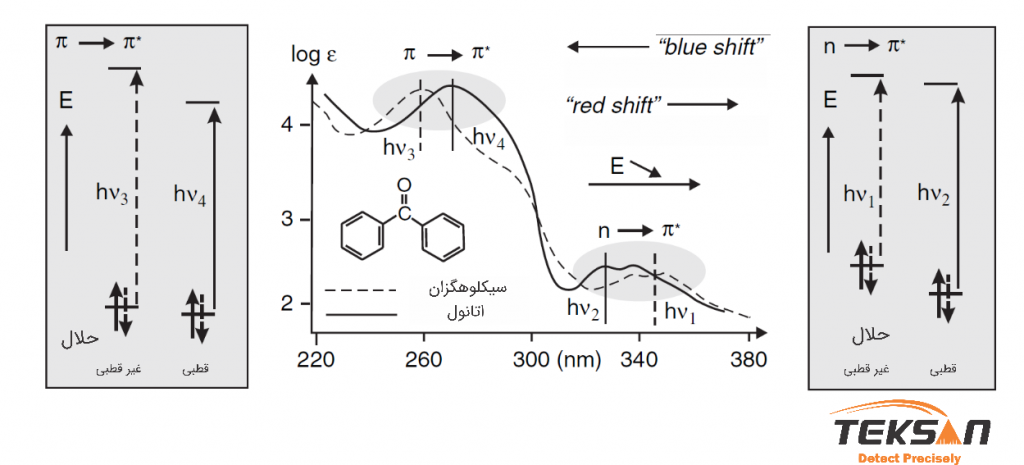
حلالها نیز طیف جذبی را تحت تأثیر قرار میدهند. قلههای حاصل از انتقال *n→π با افزایش قطبیت حلال به سمت طول موج کوتاهتر (blue shift) منتقل میشوند. اما برای انتقالهای *π→π غالبا (نه همیشه) برعکس است. یعنی قلهها به سمت طولموجهای بلندتر (red shift) جابهجا میشوند. سیکلوهگزان یک ماده غیر قطبی و اتانول قطبی است. برای انتقالهای *π→π با توجه به قطبی بودن اتانول قله به سمت طولموجهای بلندتر جابهجا شده است. زیرا قطبیت اتانول از سیکلوهگزان بیشتر است. برای انتقالهای *n→π برعکس این موضوع صادق است. یعنی چون قطبیت افزایش یافته قله به سمت طولموج کوتاهتر منتقل شده است. این موضوع در شکل ۶ نشان داده شده است.
تاثیر فاز نمونه در طیف جذبی
طیف به دست آمده از نمونهها به فاز ماده هم بستگی دارد. باندهای جذبی نمونه در حالت محلول (زمانی که نمونه را در محلول حل کردهایم) یا در حالت خالص، پهن هستند. همچنین تعداد قلهها هم کم است. در حالی که طیف به دست آمده در فاز گازی (که تحت فشار کمی است)، بسیار دقیقتر و بهتر از فاز محلول است. برای تفهیم بهتر به نمودار ۱۰ توجه کنید.
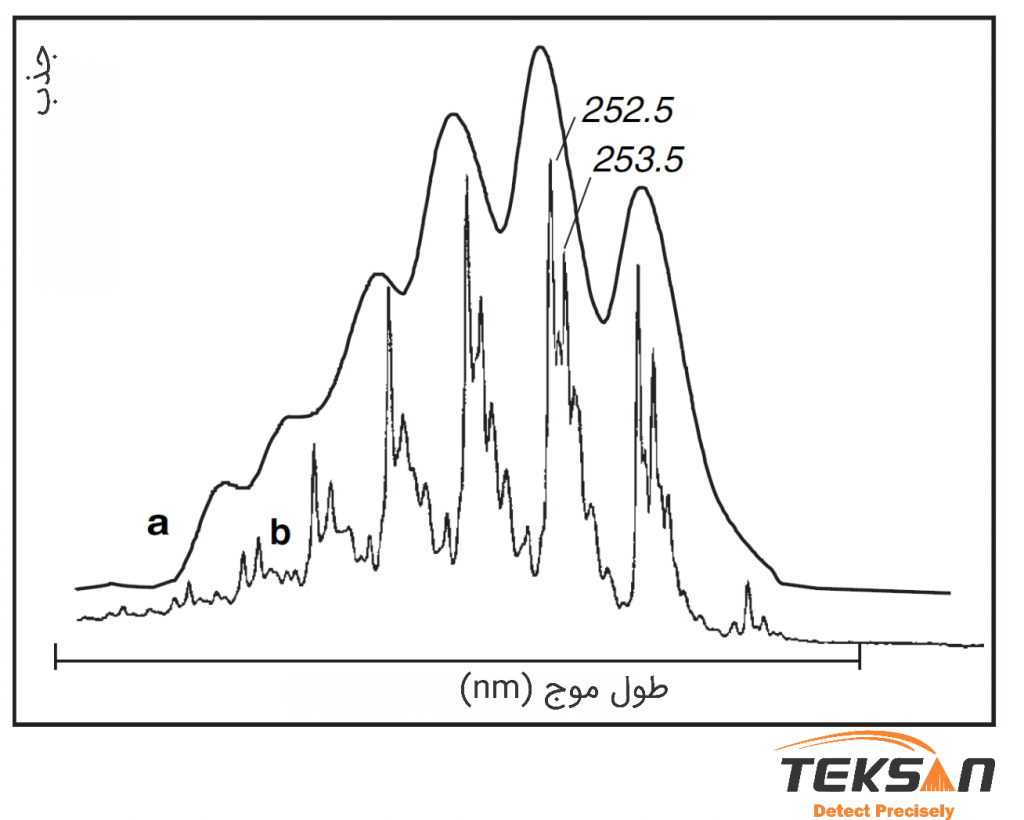
در این نمودار، a طیف جذبی به دست آمده از بنزن حل شده در یک محلول است. نمودار b هم طیف جذبی بخار بنزن است. همان طور که میبینید قلهها در نمودار a پهن هستند. به دلیل همین پهن شدگی، قلههای مجاور هم در اثر همپوشانی ناپدید شدهاند و تعداد آنها کمتر شده است. در حالی که در نمودار b تعداد قلهها بیشتر و پهن شدگی آنها نسبت به نمودار b کمتر هست.
در انتهای این مطلب لازم به ذکر است که بدانید شما میتوانید تمام این کاربردها را با اسپکتروفتومتر لِنا عملیاتی کنید.

جمعبندی
اسپکتروفتومتر دستگاهی است که میزان نور عبوری یا جذبی از یک ماده را اندازهگیری میکند. در این جا ما نحوه محاسبه میزان نور جذبی (عبوری) را بیان کردیم. همچنین گفتیم که طبق قانون بیر-لامبرت معادله غلظت و جذب خطی است. همچنین اشاره شد که اسپکتروفتومتر نمونه را به صورت کمی و کیفی تجزیه و تحلیل میکند. علاوه بر اینها دلیل استفاده از این طیف سنج را هم بیان کردیم.
همچنین بیان شد که برای تفسیر طیف لازم است تا عوامل تاثیر گذار بر طیف را بررسی کنیم. این عوامل عبارتند از: تاثیر انتقالات الکترونی بر طیف جذبی، تاثیر گروههای کروموفور بر طیف جذبی، تاثیر حلال بر طیف جذبی و تاثیر فاز نمونه بر طیف جذبی. در انتها نیز به طور خلاصه به طیف سنجی بازتابی پرداختیم و نحوه محاسبه میزان بازتاب را بیان کردیم.
برای آگاهی از زمان انتشار دانشنامهها و یا ویدیوهای آموزشی لطفا صفحه ما را در اینستاگرام دنبال کنید.
منابع
- https://zaya.io/hutjr
- https://zaya.io/vd9rf
- https://zaya.io/3s17b
- https://zaya.io/9ys4r
- https://zaya.io/inlqe
- https://zaya.io/p1h4z
- https://zaya.io/nxwb9
- https://zaya.io/hutok
- https://zaya.io/dhhbu
- https://zaya.io/079o8
- https://zaya.io/yhlzt