قانون بیر لامبرت چیست؟
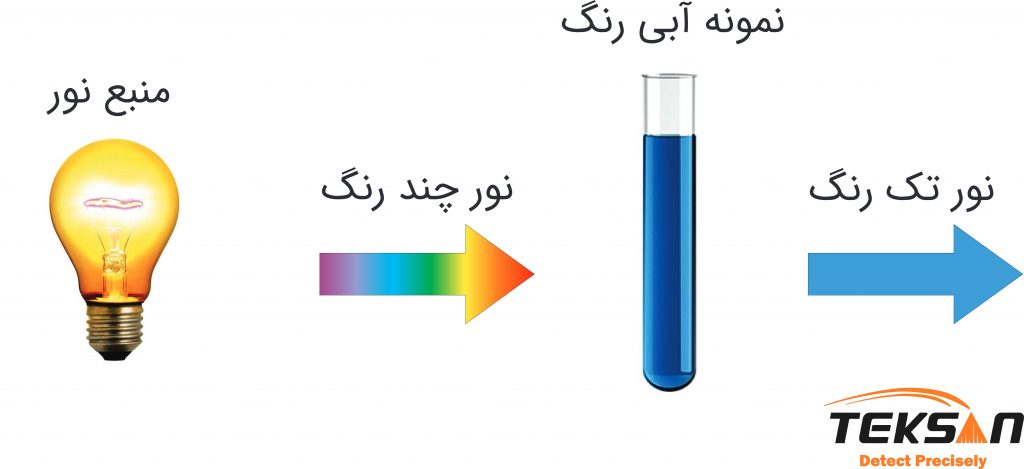
هنگامی که یک مولکول نور را جذب میکند، در واقع انرژی از پرتوی نور به مولکولهای ماده منتقل میشود. حال اگر فرکانس میدانهای الکتریکی و مغناطیسی نور با فرکانسهای ارتعاشی مولکول مطابقت داشته باشد، نور جذب مولکول میشود. به عنوان مثال اگر نور سفید از محلول آبی عبور کند، همه رنگها به جز آبی را جذب میکند (شکل ۱). یک دستگاه طیف سنجی، نورهای عبوری یا (جذبی) از ماده را تجزیه و تحلیل میکند و طیف عبوری (طیف جذبی) آن ماده را ارائه میدهد. برای طیف سنجی جذبی عبوری از قانون بیر لامبرت استفاده میشود. در واقع میتوان گفت که یکی از قانونهای مهم در مباحث طیف سنجی همین قانون بیر-لامبرت است. پس ضروری است که به بررسی این قانون بپردازیم.
قانون بیرلامبرت در اسپکتروفتومتری
قانون بیر لامبرت (Beer-Lambert law) یا قانون بیر-لامبرت-بوگوه و یا قانون لامبرت، یکی از قوانین اصلی در طیف سنجی فوتومتری و اپتیک است که احتمالا ترکیبهای دیگری از این نام هم به گوش شما خورده است.

جذب نور توسط یک نمونه متناسب با تعداد مولکولهای جذب کننده است. هرچه تعداد این مولکولها در یک ترکیب بیشتر باشد، میزان جذب نیز بیشتر میشود. بنابراین میتوان با استفاده از میزان جذب، غلظت یک محلول را به دست آورد.
طبق این قانون میزان عبور از رابطه زیر به دست میآید. به طوری که در این رابطه I شدت نور عبوری از ماده و I۰ شدت نور تابشی به ماده است.
T = I / I۰
مقدار T عددی بین ۰ و ۱ است. عدد صفر به این معنی است که همه نور تابشی به ماده جذب شده و عدد یک نشان دهنده این است که همه نور تابشی از ماده عبور میکند. معمولا مقدار T را با درصد نشان میدهند.
T (%) = 100 I / I۰
از طریق رابطه بالا میزان جذب ماده نیز به دست میآید:
A = – log I / I۰
همان طور که از روابط بالا پیدا است، میزان جذب و عبور بدون واحد هستند. همان طور که مشاهده میکنید، طبق روابط بالا میزان عبور متناسب با نسبت شدتها است. به همین دلیل واحدها از صورت و مخرج حذف میشوند.
معادله بیر-لامبرت یک رابطه خطی است که به شکل زیر بیان میشود:
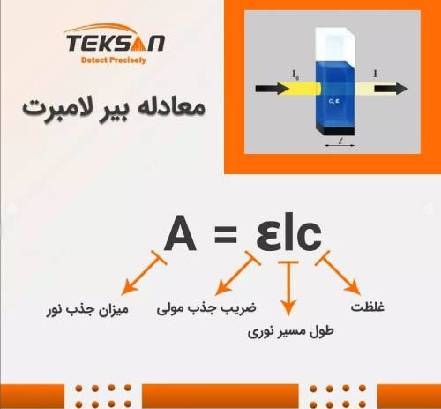
A = ɛlc
در معادله بالا ε ضریب جذب مولی، c غلظت و l طول مسیر نوری است.
ε (ضریب جذب مولی): یک خاصیت وابسته به نمونه است که از اندازهگیری میزان قدرت جذب یک نمونه در یک طولموج خاص به دست میآید.
c (غلظت): تعداد مولهای حل شده در یک محلول است.
l (مسیر نوری): طول مسیری است که نور طی میکند.

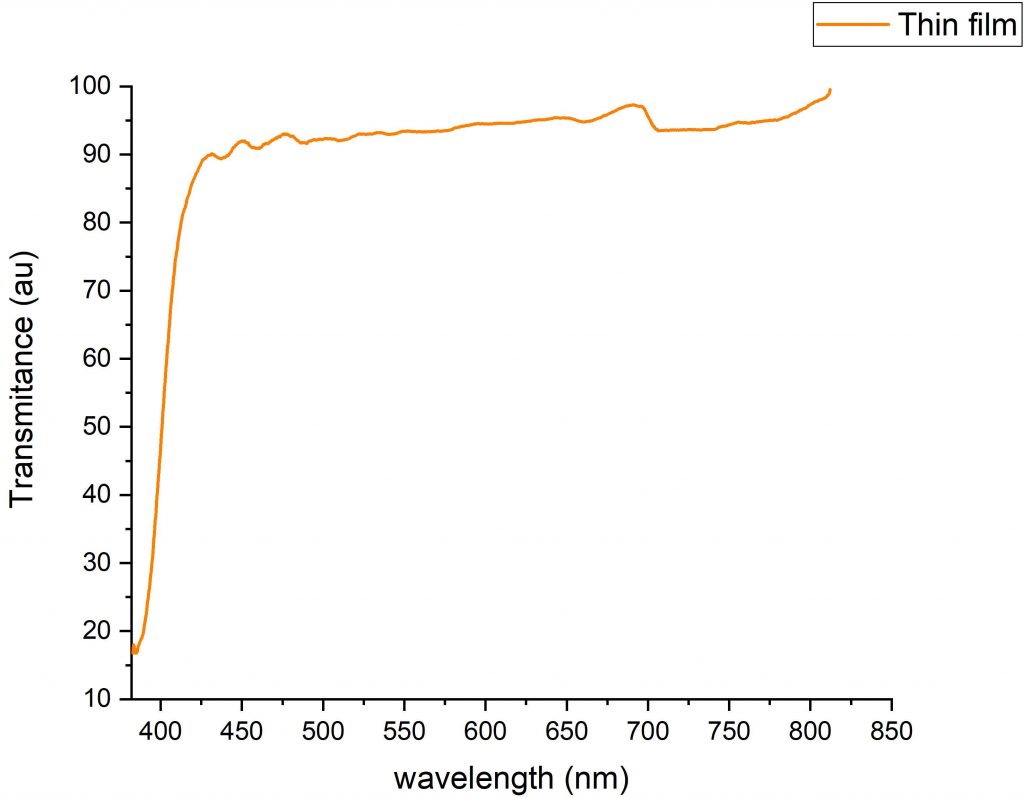
معمولا برای طیف گیری نمونههای مایع از کووت استفاده میشود. در کووتهای استاندارد این طول ۱ سانتیمتر است. نمودار ۱ طیف عبوری یک فیلم نازک (thin film) را نشان میدهد. این طیف به وسیله اسپکتروفتومتر شرکت تکسان تهیه شده است. البته همه اسپکتروفتومترها قابلیت طیفگیری از نمونههایی مانند فیلم نازک را ندارند. این شرکت با طراحی صنعتی منحصر به فرد امکان طیفگیری از چنین نمونههایی را فراهم میکند. این نمودار نشان دهنده این است که این ماده (فیلم نازک) تقریبا ٪۹۰ از نور را در طولموج ۴۳۰ نانومتر به بعد از خود عبور میدهد.
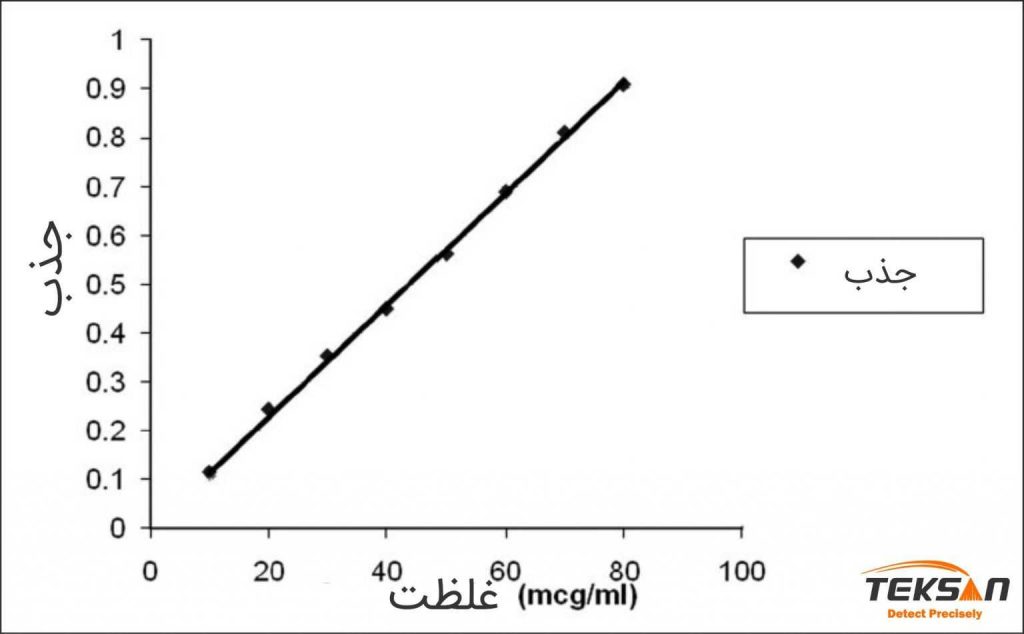
طبق قانون بیر-لامبرت در شرایط ایدهآل، غلظت ماده و میزان جذب آن به صورت خطی با هم متناسب هستند. یعنی هرچه غلظت یک محلول بیشتر باشد، نور بیشتری جذب میشود. با استفاده از اسپکتروفتومتر علاوه بر میزان جذب (عبور) نور، میتوان غلظت یک محلول را نیز اندازهگیری کرد. بدین جهت از یک منحنی استاندارد استفاده میشود. بسیاری از منحنیهای استاندارد خطی هستند و با استفاده از معادله y=mx+b ، میتوان غلظت محلول را به دست آورد. در این معادله m شیب خط و b عرض از مبدا است.
برای تعیین غلظت مجهول یک نمونه، از همان نمونه در غلظتهای مختلف تهیه میشود و میزان جذب آنها (هم غلظت مجهول و هم سایر نمونهها) در یک طول موج مشخص اندازهگیری میگردد. برای داشتن یک منحنی استاندارد خوب، حداقل ۵ غلظت مورد نیاز است. سپس با استفاده از دادههای به دست آمده یک منحنی استاندارد رسم میشود. این نمودار همان طور که در بالا ذکر شد، یک منحنی خطی است که شیب و عرض از مبدأ آن قابل محاسبه است. غلظت مجهول با در دست داشتن شیب، میزان جذب و عرض از مبدأ به دست میآید. خوب است بدانید که نحوه رسم نمودار اسپکتروفتومتری به همراه ویدئو آن در اکسل به صورت کامل برای شما عزیزان تهیه شده است. مطالعه این مطلب و مشاهده فیلم آموزشی گام به گام آن خالی از لطف نیست.
البته این قانون محدودیتهایی هم دارد که باعث میشود قانون بیر همیشه صادق نباشد.
محدودیت های قانون بیرلامبرت
- این قانون در محلولهایی که غلظت آنالیت آن خیلی زیاد است، کاربردی ندارد. زیرا در غلظتهای بالا برهمکنش حلال-آنالیت، برهمکنش آنالیت-آنالیت یا پیوند هیدروژنی بر میزان جذب تاثیر میگذارد. به عنوان مثال در غلظتهای بالا میانگین فواصل بین مولکولها یا یونهای مسئول جذب کم است. بنابراین هر ذره توزیع بار ذرات مجاور خود را تحت تاثیر قرار میدهد. این اثر از نوع برهمکنش آنالیت-آنالیت است. توجه داشته باشید که رابطه غلظت و میزان جذب خطی است. ولی در غلظتهای بالا این رابطه از خطی بودن خارج میشود.
- این قانون در غلظتهای بسیار کم نیز دچار خطا میشود. در این حالت هم غلظت آنالیت کم است ولی غلظت سایر مواد بیشتر است. بنابراین نزدیکی یونها با مولکولهای جاذب موجب برهمکنشهای الکترواستاتیکی میشود و طیف جذبی را تحت تاثیر قرار میدهد. این برهمکنشهای مولکولی معمولا در غلظتهای کمتر از ۰.۰۱ مولار قابل چشمپوشی است (البته که موارد استثنا هم وجود دارد).
علاوه بر محدودیتهای بیان شده این قانون انحرافاتی دارد که در زیر به آنها خواهیم پرداخت.
انحراف از قانون بیر لامبرت
طبق قانون بیرلامبرت رابطه غلظت و جذب خطی است. به عبارتی با افزایش غلظت، میزان جذب نیز افزایش مییابد. اما حالا میدانیم که همیشه به این صورت نیست. نمودار واقعی جذب و غلظت خطی نیست و در قسمتی از نمودار کالیبراسیون، منحنی از خط اصلی منحرف میشود (نمودار ۳). به همین دلیل به انحرافات قانون بیر-لامبرت مشهور شده است. این انحرافات به سه دلیل رخ میدهند:
- انحراف به دلایل شیمیایی
- انحرافات ابزاری
- انحراف به دلیل ظروف اندازهگیری ناهمسان

انحراف به دلایل شیمیایی
این انحراف زمانی رخ میدهد که یک آنالیت با حلال ترکیب، یا از هم تفکیک شوند و یا با هم وارد یک واکنش شیمیایی شوند. در این صورت چون ماهیت شیمیایی آنالیت عوض میشود، طیف جذبی به دست آمده دیگر متعلق به آنالیت نیست. بلکه متعلق به مادهای است که در اثر فرآیندهای شیمیایی (ترکیب، تفکیک و واکنش شیمیایی) به وجود آمده است.
حلال، ماهیت قطبی و غیر قطبی دارد. مثلا هیدروکربنهای اشباع شده، حلالهای غیر قطبی هستند و اگر کاملا خالص باشند، با مولکولهای ماده حل شونده تداخلی ندارند. اما حلالهایی مانند آب یا الکلها با توجه به اینکه قطبی هستند، اوربیتال مولکولهای آنالیت را در حالت پایه و برانگیخته تغییر میدهند. حلالها (هم قطبی و هم غیر قطبی) در طیف جذب مواد نقش برجستهای دارند. بنابراین حلال باید دارای دو ویژگی باشد:
- نباید با آنالیت برهمکنش داشته باشد.
- نباید در طیف جذب آنالیت تداخل ایجاد کند.
حلال باید بر اساس خواص جذبی در بازه طول موجی مورد نظر انتخاب شود. همچنین باید مناسب ماده و شرایط آزمایش باشد. در جدول ۱ لیست حلالهای رایج و حد پایین بازه طول موجی مفید آنها آورده شده است. هنگام استفاده از حلالهای فرار همچون استون یا سیکلوهگزان، از بسته بودن درب ظرف نمونه اطمینان حاصل کنید. تبخیر حلال میتواند سبب تغییر غلظت محلول یا جریانهای همرفتی شده و دقت اندازهگیری کاهش یابد. همچنین هنگام استفاده از آب به عنوان حلال توصیه میشود از آب دیونیزه یا آب دیونیزه HPLC استفاده نمایید تا از میزان جذب ناخواسته ناشی از ناخالصیهای آب کاسته شود.
| حلال | حد پایین بازه عبور |
| اسید سولفوریک (۹۶٪) آب استونیتریل | ۱۹۵ – ۱۸۰ نانومتر |
| سیکلوپنتان n-هگزان گلیسرول ۴٬۲٬۲-تریمتیلپنتان متانول | ۲۱۰ – ۲۰۰ نانومتر |
| n-بوتیل الکل ایزوپروپیل الکل سیکلوهگزان اتیل اتر | ۲۲۰ – ۲۱۰ نانومتر |
| کلروفرم اتیل استات متیل فرمات | ۲۶۰ – ۲۴۵ نانومتر |
| تتراکلراید کربن دیمتیل سولفوکسید دیمتیل فرمآمید استیک اسید | ۲۷۵ – ۲۶۵ نانومتر |
| بنزن تولوئن متا-زایلین | ۲۹۰ – ۲۸۰ نانومتر |
| پیریدین استون کربن دیسولفید | بالای ۳۰۰ نانومتر |
انحرافات ابزاری
این نوع انحراف به دو دسته تقسیم میشود: انحرافات ابزاری ناشی از تابش چند رنگی و انحرافات ابزاری ناشی از نورهای سرگردان.
انحرافات ابزاری ناشی از تابش چند رنگی
قانون بیر- لامبرت هنگامی صادق است که از منبع نوری تک رنگ برای اندازهگیریها استفاده شده باشد. یک منبع نوری را در نظر بگیرید که دارای دو طولموج ‘λ و ”λ است. میزان جذب برای هر ‘λ به شکل زیر نوشته میشود:
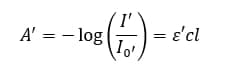
میزان جذب برای طولموج ”λ نیز به صورت زیر است:

هنگامی که در یک اندازهگیری از دو طول موج استفاده میشود، شدت پرتو خارج شده از محلول برابر مجموع شدتهای دو طولموج است. به این ترتیب میزان جذب کل Am به دست آمده از یک محلولی که تحت تابش یک منبع دو طولموجی قرار گرفته، به صورت زیر است:
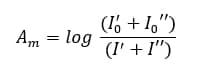
که اگر این معادله را ساده سازی کنیم به رابطه زیر میرسیم:
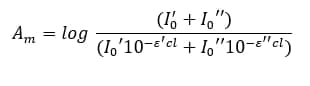
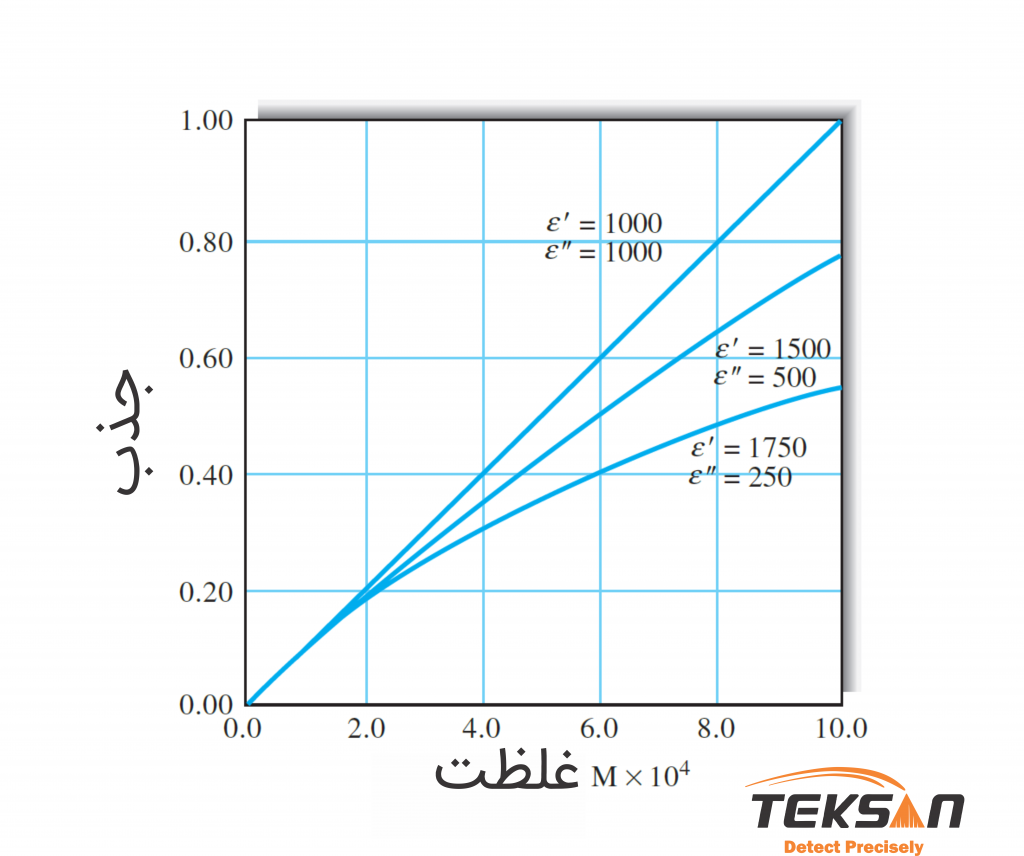
همان طور که میبینید دیگر معادله جذب و غلظت خطی نیستند. به نمودار ۴ توجه کنید. اگر ‘ε با ”ε برابر باشد (یعنی از یک نور تک رنگ برای اندازهگیری استفاده شود) در این صورت قانون بیر-لامبرت اجرا میشود. در غیر این صورت منحنی از خط ایدهآل منحرف میشود. هر چه قدر اختلاف ضریب جذبها بیشتر میشود، انحراف از خط ایدهآل هم بیشتر خواهد شد. به یاد داشته باشید که مقدار ضریب جذب مولی در یک ماده نسبت به طولموجهای متفاوت، متغیر است.
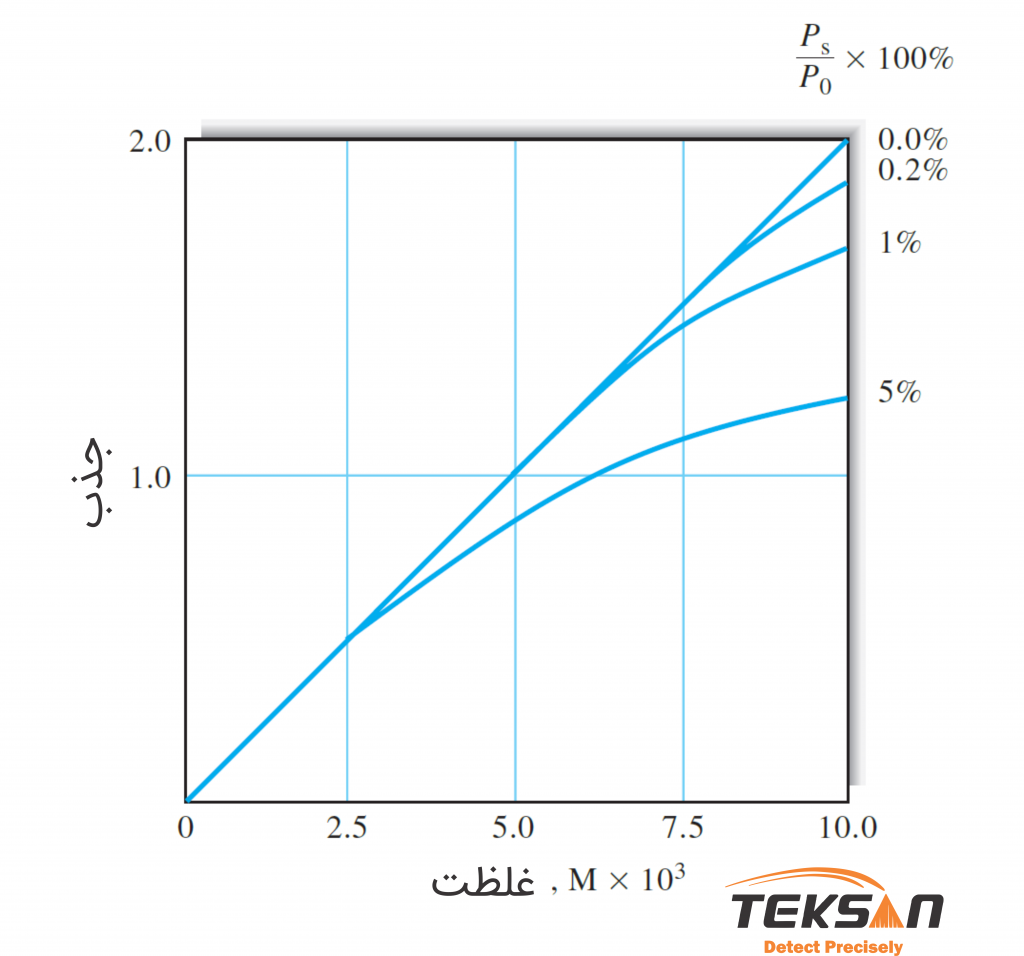
از طرفی دیگر اگر از یک طولموج برای اندازهگیری جذب استفاده میکنید، بهتر است طولموج منبع نور به λmax (این پارامتر نشان میدهد که ماده در آن طولموج بیشترین جذب را دارد) نزدیک باشد. زیرا در این صورت میزان انحراف از خط ایدهآل کمتر میشود (نمودار ۵).

انحرافات ابزاری ناشی از نورهای سرگردان
نورهای سرگردان یکی دیگر از عوامل انحراف از قانون بیر-لامبرت هستند. نورهای سرگردان در واقع نویزهای سیستم هستند. این نورها بدون عبور از نمونه وارد دستگاه میشوند و با آشکارساز برخورد میکنند. این نویزها شدت نور اضافی به سیستم وارد میکنند. به طوری که این شدت نور در میزان جذب نیز تاثیر میگذارد.
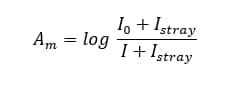
انحراف به دلیل ظروف اندازهگیری ناهمسان
اگر ظروف نگهدارنده نمونه و محلول مرجع دارای اندازه و مشخصات نوری یکسانی نباشند، نمودار کالیبراسیون منحرف میشود. به همین دلیل توصیه میشود که در طیفگیریهای خود، از ظروف یکسان استفاده کنید.
اگر شما بخواهید قانون بیرلامبرت را به صورت عملی لمس کنید و نسبت به آن حس داشته باشید، باید از یک اسپکتروفتومتر استفاده کنید.

جمع بندی
طبق قانون بیر لامبرت میزان جذب نور توسط یک محلول با غلظت آن متناسب است و یک رابطه خطی دارد. اما این رابطه همیشه صادق نیست و دارای محدودیتهایی است. به عنوان مثال این قانون برای غلظتهای بسیار زیاد و بسیار کم کاربردی ندارد. علاوه بر این قانون Beer-Lambert دارای انحافاتی است که منجر میشود تا رابطه غلظت و جذب خطی نباشد. این انحرافات به سه دلیل رخ میدهند: انحراف به دلایل شیمیایی، انحرافات ابزاری، انحراف به دلیل ظروف اندازهگیری ناهمسان.
منابع
- https://zaya.io/nlcx5
- https://zaya.io/izkus
- https://zaya.io/yr9ki
- https://zaya.io/wsg9k
- https://zaya.io/6gwsp
- https://zaya.io/2kdij
- https://zaya.io/0hlk6
- https://zaya.io/bwqxp