نحوه جذب نور توسط مولکولهای ماده
هنگامی که نور با ماده برخورد میکند چند فرایند میتواند رخ دهد:
- بازتاب
- پراکندگی
- جذب
- فلورسانس یا فسفرسانس (جذب و انتشار مجدد)
- واکنش فتوشیمیایی (جذب و شکستن پیوند)
ما در تکنیک اسپکتروفتومتری با پدیده جذب سروکار داریم. بنابراین در این مطلب نحوه جذب نور توسط مولکول را بررسی خواهیم کرد. همین طور که میدانید نور دارای انرژی است و هنگامی که با ماده برخورد میکند، موجب افزایش انرژی مولکولهای (اتمهای) آن ماده میشود. انرژی پتانسیل یک مولکول برابر با مجموع انرژیهای الکترونی (Eelectronic)، ارتعاشی (Evibrational) و چرخشی (Erotational) است.
Etotal = Eelectronic + Evibrational + Erotational
مقدار انرژی که یک مولکول دارد پیوسته نیست بلکه به صورت مجموعهای از ترازها و یا حالتهای گسسته است. تفاوت انرژی در حالتهای مختلف انرژی به شکل زیر است:
Eelectronic > Evibrational > Erotational
در ادامه بیشتر در مورد این ترازهای انرژی خواهیم گفت.
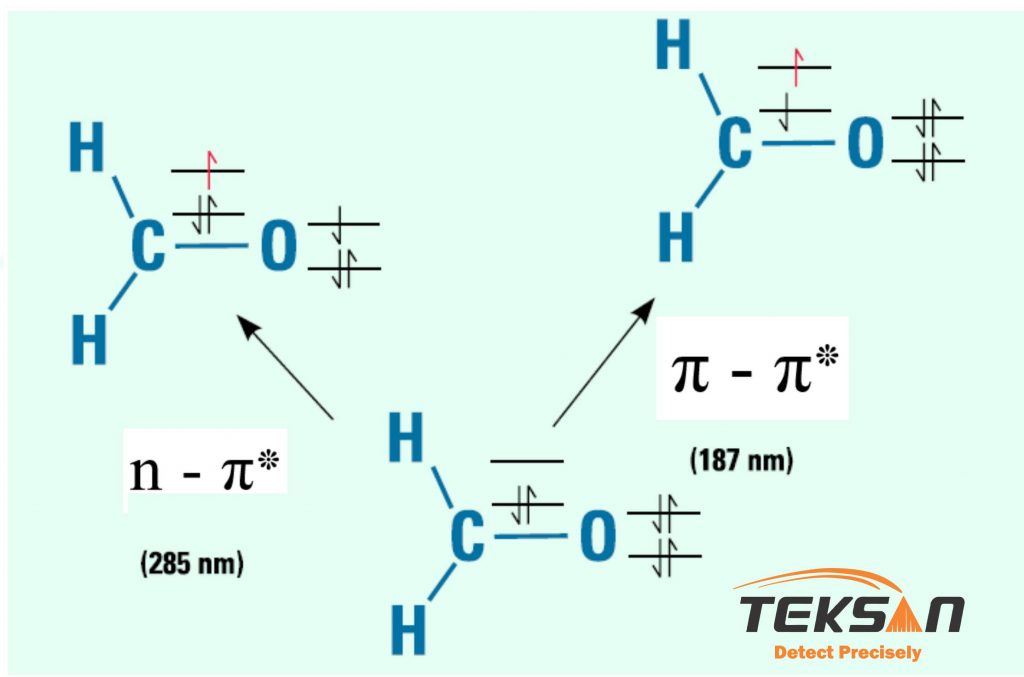
در برخی از مولکولها و اتمها، فوتونهای نور مرئی یا فرابنفش به قدری انرژی دارند که میتوانند الکترون را از یک تراز الکترونی به تراز الکترونی بالاتر منتقل کنند. این واقعیت را در نظر داشته باشید که هر چه انرژی فوتونهای نور بیشتر باشد طولموج آن کوتاهتر خواهد بود. شکل ۱ را در نظر بگیرید. این شکل انتقال الکترونی در فرمالدئید را در طولموجهای مختلف نشان میدهد.
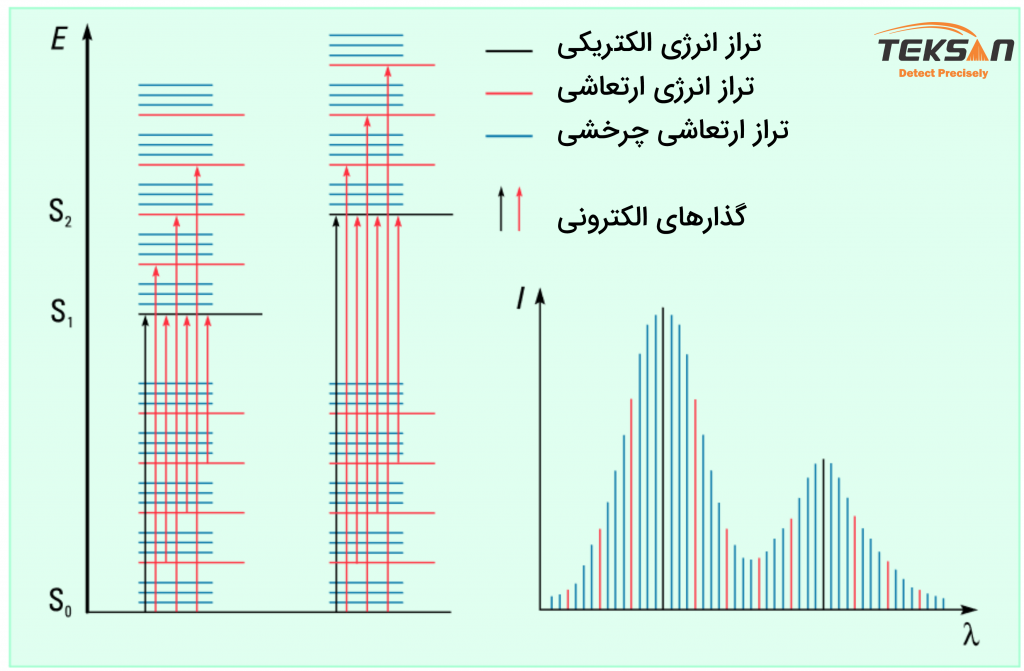
در مولکولها ترازهای انرژی ارتعاشی و چرخشی بر روی ترازهای انرژی الکترونی قرار میگیرند. با توجه به این که گذارهای متعدد با انرژیهای مختلفی صورت میگیرد، هر یک از این سطوح انرژی به صورت یک خط نیست و یک پهنایی را شامل میشود (شکل ۲).
پیشتر گفتیم که انرژی Uv-Vis به قدری است که الکترونها میتوانند از یک تراز الکترونی به تراز الکترونی بالاتر گذار کنند. با توجه به این اصل در ادامه گذارهای الکترونی را بررسی خواهیم کرد.
گذار الکترونی
انواع اوربیتالهای مولکولی را میتوان مانند شکل ۳ نشان داد. در این شکل علاوه بر اوربیتالها انرژی نسبی آنها نسبت به هم نشان داده شده است. بر اساس شکل ۳ زمانی که در مثال فرمالدئید الکترون از اوربیتال π به *π گذار میکند به انرژی بیشتری نسبت به گذار n به *π نیاز دارد.
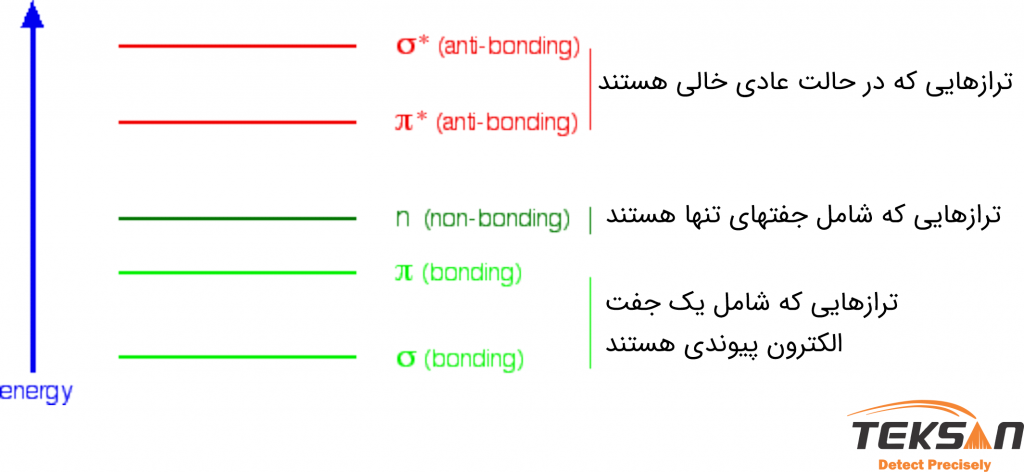
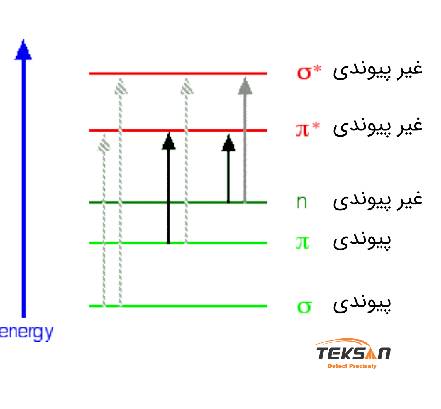
هنگامی که نور از داخل یک محلول عبور میکند، انرژی نور موجب میشود تا الکترون از یک اوربیتال پیوندی (یا غیر پیوندی) به یک اوربیتال غیر پیوندی خالی گذار کند. به شکل ۴ دقت کنید. در این شکل گذارهای مهم الکترون در هنگام برخورد نور با ماده را نشان دادهایم.
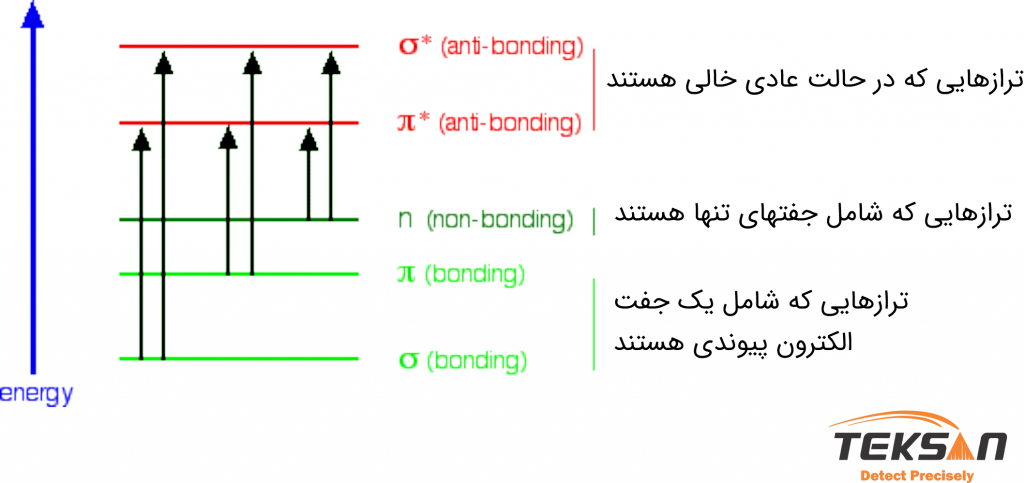
محدوده طیفی اسپکتروفتومتر UV-Vis از ۲۰۰ نانومتر (فرابنفش نزدیک) تا ۹۰۰ نانومتر (مادون قرمز نزدیک) است. بنابراین وقتی نور UV-Vis با ماده برخورد میکند، برخی از گذارهای الکترونی محتملتر هستند. یعنی فقط تعداد محدودی از گذارهای الکترونی ممکن است توسط طیف نوری (مرئی-فرابنفش) جذب شوند. در شکل ۵ احتمال گذارهای مختلف را با رنگهای متفاوت نشان دادهایم. در این شکل گذارهای مهم رنگ مشکی و گذارهای کم اهمیتتر رنگ خاکستری دارند. خطوط نقطه چین خاکستری رنگ هم گذارهایی را نشان میدهد که خارج از محدوده طیف مرئی-فرابنفش رخ میدهد. همان طور که میدانید گذارهای بزرگتر به انرژی بیشتری نیاز دارند. بنابراین طولموجهای کوتاه نور را جذب میکنند که انرژی بیشتری دارد.
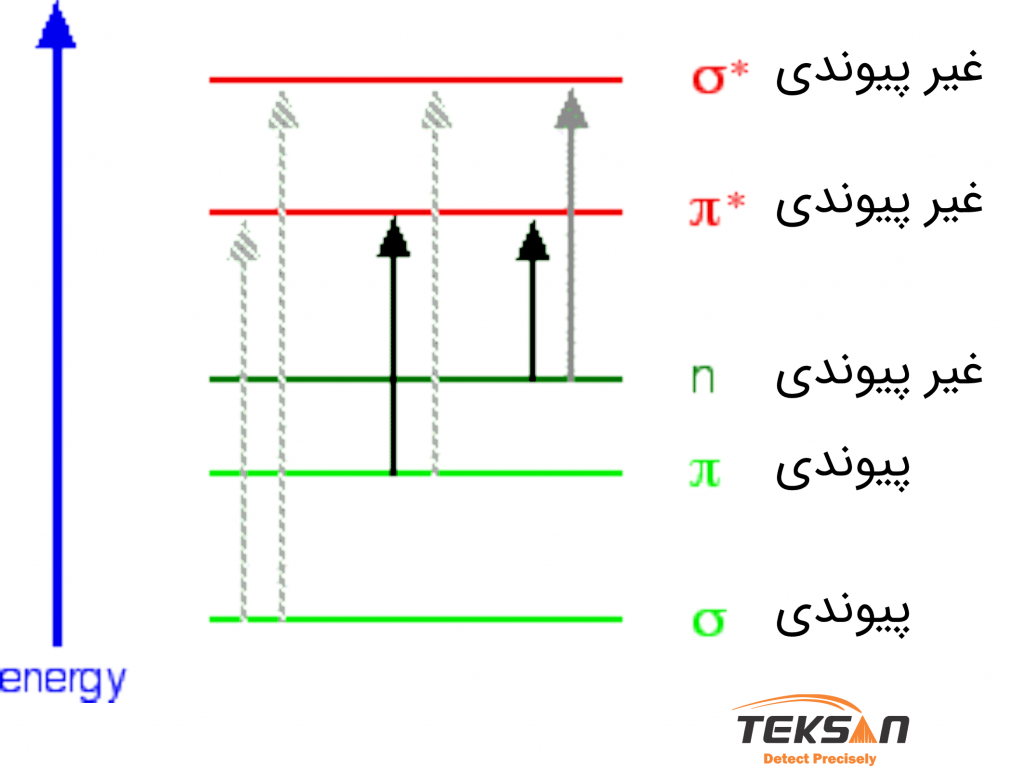
گذارهای مهمی که در جذب نور مرئی-فرابنفش رخ میدهد عبارتاند از:
- گذار از اوربیتالهای پیوندی π به اوربیتالهای ضد پیوندی (anti-bonding) *π.
- گذار از اوربیتالهای غیر پیوندی (non-bonding) به اوربیتالهای ضد پیوندی (anti-bonding) *π.
- گذار از اوربیتالهای غیر پیوندی (non-bonding) به اوربیتال های ضد پیوندی (anti-bonding) *σ.
از مطالعه گذارها متوجه میشویم برای این که نور UV-Vis توسط مولکولهای ماده جذب شود، مولکول باید حاوی پیوندهای π یا اتمهایی با اوربیتالهای غیر پیوندی باشد.
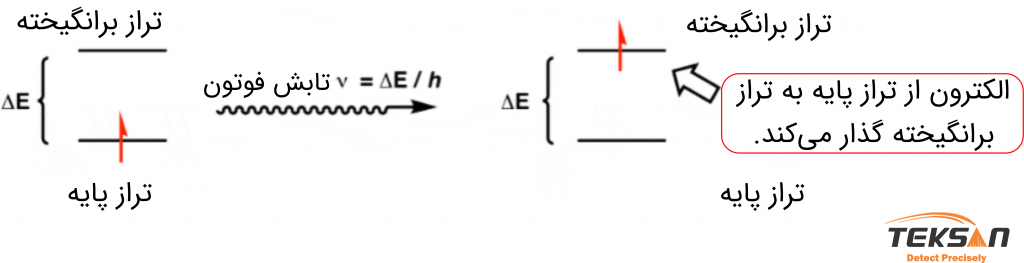
زمانی که یک مولکول فوتونی با فرکانس υ جذب میکند، در اثر انرژی فوتون از تراز پایه به تراز برانگیخته گذار میکند. فاصله این دو تراز از هم به اندازه E∆ است (شکل ۶). اما باید توجه کنید که این گذار زمانی رخ میدهد که انرژی فوتون برابر با اختلاف انرژی دو تراز پایه و برانگیخته باشد. مطابق با این تعریف میتوانیم رابطه زیر را برای این پدیده داشته باشیم.
∆E = hυ = hc/λ → λ=hc/∆E
h در این رابطه ثابت پلانک، υ فرکانس فوتون و E∆ اختلاف انرژی دو تراز پایه و برانگیخته است.
نکتهای که در این جا اهمیت پیدا میکند و باید به آن توجه کنیم این است که هر چه تعداد پیوندهای دوگانه (پیوند π) در یک مولکول افزایش یابد اختلاف انرژی (E∆) کاهش مییابد (افزایش طول موج). بر این اساس میتوان گفت که به کمک طیفسنجی مرئی-فرابنفش میزان جذب بر حسب طولموج قابل محاسبه است. بنابراین میتوان نتیجه گرفت به هر میزان که مولکول پیوند دوگانه بیشتری داشته باشد، طولموج ماکزیموم به سمت طولموجهای بلندتر جابه جا میشود.
به طور مثال مولکول هیدروژن H۲ را در نظر بگیرید. مولکول هیدروژن از یک پیوند σ با انرژی کمتر و یک پیوند با انرژی بالاتر *σ تشکیل شده است. شکل ۷ تصویر اوربیتال مولکولی هیدروژن را نشان میدهد. هنگامی که مولکول در حالت پایه قرار دارد، هر دو الکترون در اوربیتال پیوندی (σ) با انرژی پایینتر جفت میشوند. این بالاترین اوربیتال مولکولی اشغال شده ((HOMO) Molecular Orbital Highest Occupied) است. اوربیتال ضد پیوندی *σ، به نوبه خود پایینترین اوربیتال مولکولی اشغال نشده (Lowest Unoccupied Molecular Orbital (LUMO)) است.
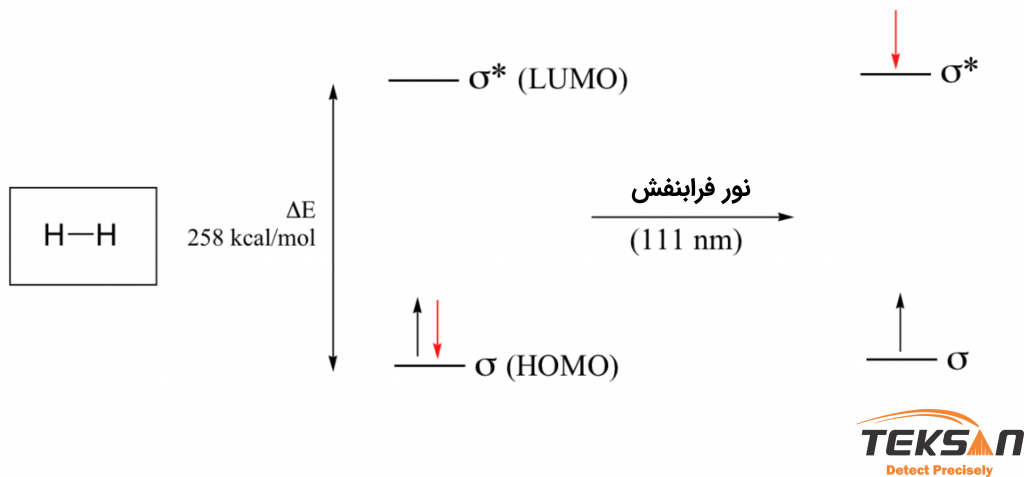
اگر انرژی نور تابشی با اختلاف انرژی HOMO-LUMO برابر باشد، این نور توسط مولکول جذب میشود و انرژی لازم برای انتقال الکترون از حالت HOMO به LUMO فراهم میگردد. به عبارتی دیگر الکترون از اوربیتال σ به اوربیتال ضد پیوندی *σ گذار میکند. ΔE برای این انتقال الکترونیکی ۲۵۸ کیلوکالری بر مول است که مرتبط به نوری با طولموج ۱۱۱ نانومتر است.
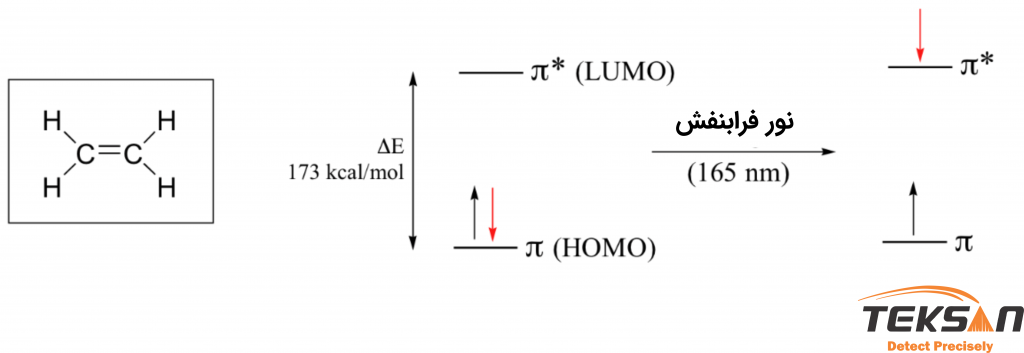
هنگامی که یک مولکول با پیوند دوگانه مانند اتن (نام تجاری اتیلن) نور را جذب می کند، تحت یک گذار * π – π قرار می گیرد. از آن جا که اختلاف انرژی * π – π کوچکتر از اختلاف انرژی *σ – σ هستند، اتن نور را در طولموج ۱۶۵ نانومتر جذب میکند یعنی با طول موجی بیشتر از طول موج لازم برای انتقال الکترون در مولکول هیدروژن (شکل ۸).
جمع بندی
در این مطلب در مورد نحوه جذب مرئی و فرابنفش توسط مولکولهای ماده صحبت کردیم. همچنین گذارهای الکترونی را به طور کامل بررسی کردیم و شرح دادیم که احتمال گذار در کدام حالتها بیشتر است. همچنین بیان کردیم که نور با چه میزان انرژی میتواند جذب مولکول شود.
منابع
۱- https://zaya.io/9jt44
۲- https://zaya.io/jo5yr